(一) 一些化合物的稳定构象
一些乙烷取代物的对位交叉式和邻位交叉式的相对能量(kJ•mol–1, 每组左边的构象相对能量为零)标注在Newman投影式下面:
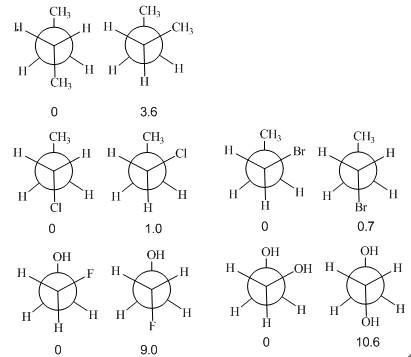
由于两个甲基的非键张力,使得丁烷邻位交叉式构象比对位交叉式能量高;1-氯丙烷邻位交叉式构象中,由于氯原子吸电子诱导效应,氯原子带部分负电荷,甲基上带部分正电荷,即甲基和氯除存在非键张力外还存在偶极吸引作用,但非键张力为主,仍是对位交叉式稳定;1-溴丙烷由于C-Br键加长,非键张力减弱,反而邻位交叉式构象略微稳定;2-氟乙醇则是F与羟基上的H之间的强偶极吸引作用为主,乙二醇则是分子内氢键为主,因而都是邻位交叉式稳定。
下表列出了单取代环己烷取代基在直立键上与平伏键上的自由能的差值,可以看出象氰基、乙炔基那样的线型取代基、半径很小的F, OH以及键长较长的Cl, Br, I在直立键上与在平伏键上的能量差别不大。
单取代环己烷取代基在a键与e键自由能差值
取代基 |
⊿G(kJ•mol–1) |
取代基 |
⊿G(kJ•mol–1) |
取代基 |
⊿G(kJ•mol–1) |
CN |
0.8 |
OMe |
3.1 |
CH=CH2 |
7.1 |
F |
1.0 |
OH |
3.8 |
CH3 |
7.3 |
C≡CH |
1.7 |
NO2 |
4.6 |
C2H5 |
7.3 |
I |
1.9 |
COOEt |
4.6 |
i-Pr |
9.0 |
Br |
2.0 |
COOMe |
5.3 |
C6H11 |
9.0 |
Cl |
2.2 |
COOH |
5.7 |
C6H5 |
11 |
OAc |
3.0 |
NH2 |
5.9 |
t-Bu |
21 |
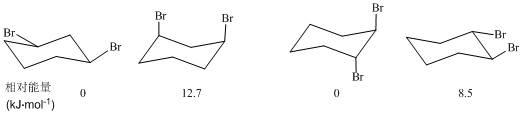
二取代环己烷的情况有所不同,例如:顺-1,3-二溴环己烷,当两个溴原子都处于直立键时,因为C―Br键等长,偶极排斥和非键张力都很大,两个溴原子都在直立键上比都在平伏键上能量高12.7 kJ•mol–1,远高于单个Br的能量差的二倍。而反-1,2-二溴环己烷则是两个Br都在直立键上稳定,因为两个溴原子都在平伏键上时因为距离较近,偶极排斥较强烈。
(二) 小环化合物的稳定性
下列三个化合物为同分异构体:
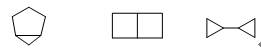
其标准生成焓分别为39 kJ/mol,125kJ/mol和130 kJ/mol,所以第一个最稳定,最后一个最不稳定,两个四元环构成的二环化合物不如由一个五元环和一个三元环构成的桥环化合物稳定。
(三) 烷烃和环烷烃的构象
概括的讲,含有两个或两个以上多价原子的分子,依靠键旋转所能达到的各种几何形状称为构象。分子的构象表达式称为构象式。构象式一般用锯架式和Newman投影式表示。在一个分子的无穷多构象中,将能量最低(或较低)和最高(或较高)的构象称为极限构象。如乙烷有两种极限构象(见图2.1),丁烷有六种极限构象(见图2.2),它们互为构象异构体。其中能量最低的构象称为优势构象。
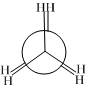
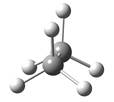
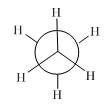
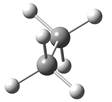
图2.1 乙烷的重叠式和交叉式构象的Newman投影表示式及其球棍模型
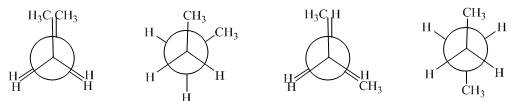

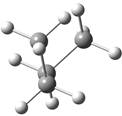
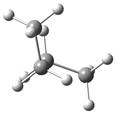
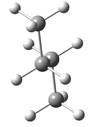
图2.2丁烷的全重叠式、邻位交叉式、部分重叠式和对位交叉式构象的
Newman投影表示式及其球棍模型
环丙烷只能采取平面结构,环丙烷不仅具有很大的角张力,其所有C―H键都是重叠的,因此还具有明显的扭转张力,因此环丙烷是最不稳定的单环烷烃。在环丁烷的平面构象中,所有C―H键也彼此重叠,因而扭转张力较大,事实上,环丁烷主要采取蝶型构象,虽然角张力有所增加,但扭转张力减小。环丁烷的蝶型构象是角张力与扭转张力两种矛盾调和的结果。
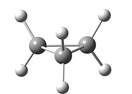
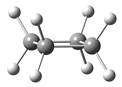
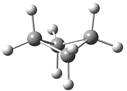
图2.3 环丙烷、平面型环丁烷和蝶型环丁烷的球棍模型
环戊烷取平面型构象时C―H键之间的扭转张力太大。环戊烷通常采取信封式和扭曲式构象,见图2.4。在环戊烷的信封式构象中,四个碳原子共平面,只有一个碳原子向上翘起;在扭曲式构象中,三个碳原子共平面,剩下的两个碳原子一个偏向平面上边,一个偏向下边,两种构象扭转张力都得到一定程度缓解,能量接近。
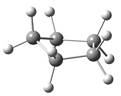
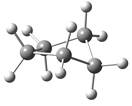
图2.4 环戊烷信封式构象和扭曲式构象的球棍模型
环己烷分子的极限构象是椅型构象和船型构象等,其中椅型构象中所有相邻的键都处于交叉式,是能量最低的构象,见图2.5。
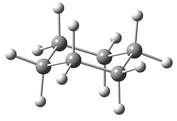
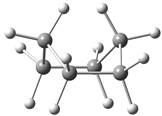
图2.5 环己烷的椅型和船型构象的球棍模型
对于一取代环己烷分子,一般是取代基处于平伏键(e键)的构象最稳定。对于多取代环己烷分子,通常是取代基(尤其是较大的取代基)处于e键的越多越稳定。
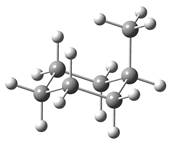
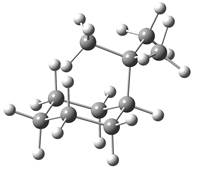
图2.6 取代基处于a键时甲基环己烷和叔丁基环己烷的球棍模型
(四) 诺贝尔奖获奖者工作介绍
1969年诺贝尔化学奖得主哈塞尔(Odd Hassel,1897-1981)先后在挪威奥斯陆大学、德国慕尼黑大学和柏林大学学习,1924年在柏林大学获得博士学位。1925年以后回到挪威奥斯陆大学任教。
1840年,沙赫斯(H. Sechse)就认为环己烷中的六个碳原子可以不在同一平面上。三十年以后,莫尔(E. Mohr)提出环己烷可以形成两种折叠着的环系:椅型和船型。
哈塞尔在1930年开始研究环己烷及其衍生物的立体结构,他在实验中发现环己烷主要以两种形式存在,也就是椅式和船式,其中椅式的稳定性远远大于船式,两种立体构象可以相互转换。他在研究环己烷及其衍生物的立体结构时,采用了X-射线衍射晶体结构分析和光谱的方法。他阐明了有机化合物构象分析的原理和方法,其研究成果已经在有机化学教学和科研中被广泛使用。
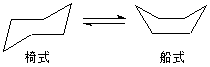
1946年哈塞尔用X-射线衍射法研究两种十氢化萘,证明顺十氢化萘并不是两个船式环,而是由两个较稳定的椅式环并合而成的体系。
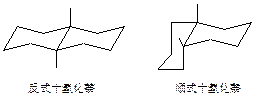
哈塞尔在研究非键原子之间的相互作用方面也做了大量工作,他发现许多生物分子都是在一定的立体构象时才具有生物活性。
哈塞尔因在有机化合物的构象分析方面的卓越贡献而与巴顿共同获得1969年诺贝尔化学奖。
