(一) 亚甲基环丙烷与亚甲基环丁烷亲电加成方向
亚甲基环丙烷按照碳正离子历程进行亲电加成时,质子加到环碳原子上有利,这是由于环丙基甲基正离子中三元环弯曲的σ轨道与正电荷所在空的2p轨道的交盖,使其相对能量比1-甲基环丙基正离子(存在很大角张力)的能量低54 kJ·mol-1:
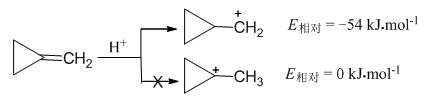
而亚甲基环丁烷按照碳正离子历程进行亲电加成时,质子加到亚甲基上有利,因为1-甲基环丁基正离子(角张力不很突出)的相对能量比环丁基甲基正离子的能量低87 kJ·mol-1:
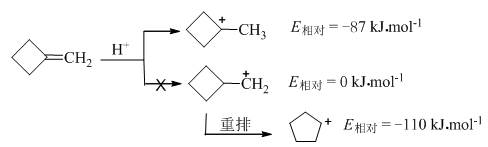
而且,环丁基甲基正离子即使出现,也会立即重排为更稳定的环戊基正离子。
(二) 炔烃水合机理
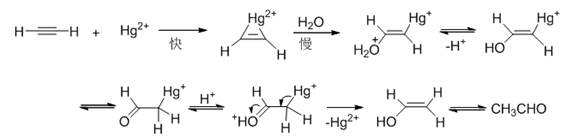
(三) 乙炔三聚的可能机理
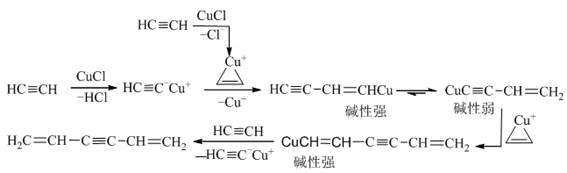
(四)关于环氧化反应
环氧化仅限于烯烃,三键不易发生环氧化。因为三键环氧化产物“环氧乙烯”角张力太大,不稳定。
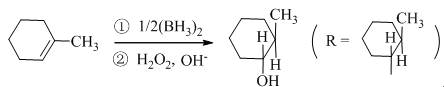
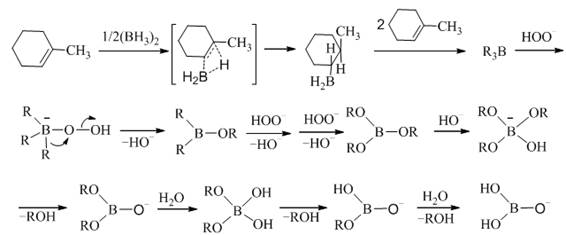
(五) 硼氢化-氧化反应机理
以下列反应为例说明如下:
(六) 取代基对活性中间体稳定性影响
碳正离子缺电子,超共轭效应和给电子的共轭效应对碳正离子的稳定作用显著,例如叔丁基正离子、甲氧甲基正离子都很稳定。
自由基是电中性的,p,π-共轭作用更大,超共轭效应贡献很小。例如叔丁基正离子的能量比甲基正离子低303 kJ·mol-1,而相应的叔丁基自由基能量仅比甲基自由基低38 kJ·mol-1。又如:烯丙基正离子不如叔丁基正离子稳定,但是烯丙基自由基要比叔丁基自由基稳定得多。
吸电子诱导效应和吸电子共轭效应对碳负离子稳定性贡献大。
一些常见碳正离子和自由基在气态的相对能量(kJ•mol-1)
碳正离子结构 |
能量a |
文献值 |
相应自由基的相对能量b |
自由基能量(文献值) |
CH3+ |
0.0 |
0.0 |
0.0 |
438 |
H2C=CH+ |
-102 |
-116 |
26 |
444 |
C2H5+(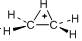 ) ) |
-180 |
-158 |
-19 |
419 |
i-C3H7+ |
-281 |
-273 |
-29 |
401 |
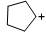
|
-308 |
-286 |
-31 |
|
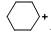
|
-338 |
|
-31 |
400 |
t-C4H9+ |
-357 |
-346 |
-39 |
400 |
HC≡CCH2+ |
-197 |
|
-67 |
|
H2C=CHCH2+ |
-260 |
-246 |
-70 |
361 |
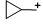
|
-318 |
|
-32 |
|
PhCH2+ |
-337 |
-320 |
-69 |
368 |
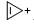
|
-390 |
|
-61 |
|
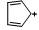
|
-235 |
|
-88 |
|
|
-528 |
|
-117 |
|
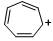
+CH2OCH3 |
-320 |
|
-37 |
|
+CH2N(CH3)2 |
-490 |
|
-58 |
|
+CH2CF3 |
58 |
|
7 |
|
a. 作者在B3LYP/6-31-G*水平下的量化计算结果;b.作者根据键能计算结果。
(七) 炔键是高能的官能团
下面表中化合物都符合(CH)n通式,它们的标准生成焓都可以在网上查到。因为分子式不同,比较它们的标准生成焓没有实际意义。但是如果比较每个CH单元的生成焓,可以看出一些规律:
化合物1、3、4、5都不太稳定,因为它们都存在很大的角张力。
乙炔2很不稳定,含有炔键的共轭分子6和7也不算稳定,出乎我们的意料。
尤其是乙炔,其CH单元的平均生成焓是很高的,即乙炔是高能分子,用乙炔焰来切割金属也就不足为奇了。因此我们可以得出结论:炔键是高能的官能团。富烯9存在具有芳香性的偶极离子极限结构: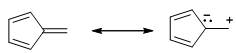 ,因而CH单元的平均生成焓比以上化合物低。环辛四烯是非平面的烯,CH单元的平均生成焓略高于含有苯环结构的11和12,当然,与我们预期结果一致,苯是完美的芳香分子,生成焓和CH单元的平均生成焓最低。
,因而CH单元的平均生成焓比以上化合物低。环辛四烯是非平面的烯,CH单元的平均生成焓略高于含有苯环结构的11和12,当然,与我们预期结果一致,苯是完美的芳香分子,生成焓和CH单元的平均生成焓最低。
化合物 编号 |
分子式 |
结构式 |
ΔfH°gas(kJ/mol) (文献值) |
CH单元 平均生成焓 |
1 |
C4H4 |
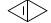
|
544 ± 42 |
136 |
2 |
C2H2 |
≡ |
227 |
113.5 |
3 |
C6H6 |
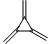
|
396 ± 12 |
99 |
4 |
C6H6 |
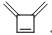
|
336 |
84 |
5 |
C8H8 |

|
622.2 ± 4.2 |
77.8 |
6 |
C4H4 |

|
295 |
73.8 |
7 |
C6H6 |

|
377.4 |
62.9 |
8 |
C8H8 |

|
484.7 |
60.6 |
9 |
C6H6 |
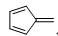
|
224 |
56 |
10 |
C8H8 |
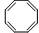
|
297.6 ± 1.3 |
37.2 |
11 |
C8H8 |
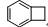
|
199.4 ± 0.9 |
24.9 |
12 |
C8H8 |
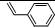
|
147 |
18.4 |
13 |
C6H6 |
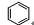
|
82.8 |
13.8 |
至于炔键为什么含有如此高的能量,目前还没有合理的解释。三键两个原子核距离较近而产生排斥的说法也缺乏支持。例如:HC≡CH、HC≡N和N≡N三键键长分别为0.120 nm、0.115 nm、0.110 nm,而其稳定性是依次增高的,HC≡CH和HC≡N分别三聚为苯、均三嗪焓变分别为-598 kJ/mol、-180 kJ/mol。N≡N的三聚体六氮杂苯很不稳定,无法合成。
(八) 从C6H12各个异构体的生成焓数据看取代乙烯稳定性
分子式为C6H12的同分异构体的生成焓
中文名称 |
英文名称 |
键线式 |
ΔfH0gas/kJ·mol-1 |
|
环己烷 |
cyclohexane |
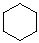
|
-124.6 |
|
甲基环戊烷 |
methyl-cyclopentane |
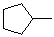
|
-106.0 |
|
2,3-二甲基-2-丁烯 |
2,3-dimethyl-2-butene |
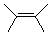
|
-70.3 |
|
(E)-3-甲基-2-戊烯 |
(E)-3-methyl-2-pentene |
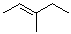
|
-63.5 |
|
(Z)-3-甲基-2-戊烯 |
(Z)-3-methyl-2-pentene |
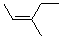
|
-61.9 |
|
2,3-二甲基-1-丁烯 |
2,3-dimethyl-1-butene |
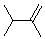
|
-61 |
|
2-乙基-1-丁烯 |
3-methylene-pentane |
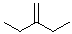
|
-56.1 |
|
(E)-2-己烯 |
(E)-2-hexene |

|
-52.5 |
|
(E)-3-己烯 |
(E)-3-hexene |

|
-51.5 |
|
4-甲基-1-戊烯 |
4-methyl-1-pentene |
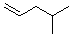
|
-49.4 |
|
(Z)-2-己烯 |
(Z)-2-hexene |
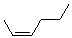
|
-47.9 |
|
(Z)-3-己烯 |
(Z)-3-hexene |
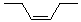
|
-47.4 |
|
1-己烯 |
1-hexene |

|
-42.2 |
|
乙基环丁烷 |
ethyl-cyclobutane |
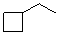
|
-27.7 |
|
稳定性: 六元环>五元环>>四元环;反式>顺式;双键上烷基越多越稳定。
(九) 下列化合物哪个稳定?
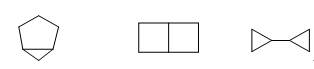
答:三个化合物为同分异构体,其标准生成焓分别为39 kJ/mol、125kJ/mol和130 kJ/mol,所以第一个最稳定,最后一个最不稳定。
(十) 诺贝尔奖获奖者工作介绍
布朗(Herbert C. Brown,1912-2004)出生于英国伦敦,他两岁时随家人迁往美国,14岁时他的父亲去世,生活十分贫困。他一边工作养家糊口,一边在业余时间坚持学习。在1935年春他获得芝加哥大学奖学金,插入三年级学习,1938年获得博士学位。1939-1943年在芝加哥大学任教,1943-1947年转到韦恩州立大学工作,1947年后在普渡大学任教。
布朗在芝加哥大学的博士论文是“二硼烷还原羰基化合物”,他之所以选择硼化合物的研究作为他的博士论文研究内容,原因之一是在布朗大学毕业时,他的女友Sarah Baylen送给他一本书作为给毕业礼物,书名是“硼和硅的氢化物”,Sarah Baylen后来成为布朗的妻子。布朗读了这本书,对书中内容十分感兴趣,硼化合物的研究和应用成为他一生的主要研究领域,并且取得了丰硕的成果。布朗在1979年获得诺贝尔化学奖时回忆说:“Sarah Baylen 之所以买《硼和硅的氢化合物》这本书作为礼物送给他,是因为当时他们都很穷,Sarah Baylen只能无奈地选择了书店里最便宜的一本书(2.06美元)”。
布朗在做博士论文时发现(BH3)2 与醛、酮反应,然后水解可以生成醇:
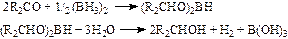
1942年布朗等利用下面反应合成了硼氢化钠:
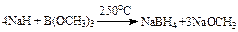
NaBH4为无色晶体,在干燥空气中稳定。布朗在尝试能溶解NaBH4的溶剂时,发现它能和丙酮反应,水解后生成异丙醇。并且发现NaBH4可以将酮、醛和酰氯还原成醇,而对其它化合物则几乎是不反应的。
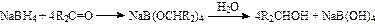
1951年以后布朗等比较了不同的金属氢化物对羰基、羧酸衍生物等的还原能力,发现LiAlH4的还原能力远远大于NaBH4,LiAlH4可以还原醛、酮、羧酸衍生物、腈、硝基等。
1955年,布朗让他的印度留学生R. C. Subba Rao研究在BF3存在下,NaBH4对有机化合物的还原反应,发现醛或酮与等物质的量的氢化物反应生成醇,乙酸乙酯或硬脂酸则消耗2倍量的氢化物而还原为醇。但是1 mol油酸乙酯[CH3(CH2)7CH=CH(CH2)7COOC2H5]不是消耗2 mol,而是消耗2.4 mol氢化物。Subba Rao认为所用的油酸可能是不纯的,要把油酸乙酯从酯类的表中除去。而布朗不同意,要求他重复进行实验。经过大量实验,终于发现应用醚类溶剂时,硼烷和烯烃间发生了硼氢化反应,而且反应进行得非常快。这一反应实际上是烯键和乙硼烷的反应,乙硼烷可以从NaBH4和三氟化硼反应产生:

1956年布朗等用含有B-H的化合物的处理烯烃,然后再用H2O2氧化得到了醇:
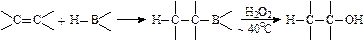
并且发现=B-H对烯烃的加成是反马氏规则的:
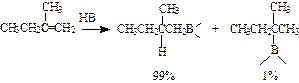
=B-H对烯烃的加成是顺式加成:
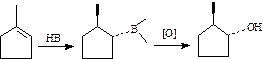
烯烃或炔烃和B-H键的加成反应得到有机硼化合物的反应称为硼氢化反应,这一反应是H、C和B结合的反应,刚好布朗教授的名字的字头为H、C、B,所以布朗在诺贝尔奖颁奖演讲中风趣地说:“我的父母有先见之明”。
布朗所开拓的有机硼氢化合物及其在有机合成中的应用研究,极大地促进了有机硼化学的发展,并且在有机化学教学、科研和精细有机化学品的生产中得到广泛应用。布朗因此和维蒂希(G. Wittig)共同获得了1979年诺贝尔化学奖。
