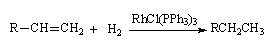(一) 累积双键二烯烃的稳定性
C5H8同分异构体的气态标准生成焓数据如下(单位为kJ·mol-1):

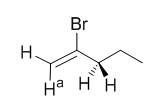
由上述数据可以看出,累积双键二烯烃的内能比非共轭的二烯烃能量高,与同分异构的炔烃相当。尽管1-戊炔的内能比1,2-戊二烯的内能略高,然而2-溴-1-戊烯在NaNH2作用下发生消除反应只会得到1-戊炔,这可能是由于下列原因:①Ha正好处于Br的反位;②Ha在电负性较大双键碳原子上,酸性较强;③空间位阻小,利于碱夺取Ha。而亚甲基上的H除酸性较弱外,要么构象不合适,要么空间效应太大。
(二) 炔烃臭氧化反应的机理
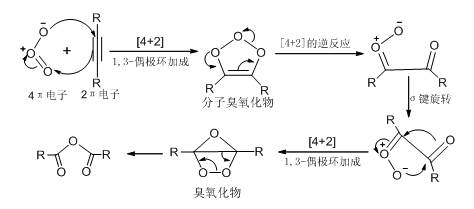
其中臭氧化物包含一个三元环和一个四元环(角张力很大)和弱的过氧键,因此很快重排为稳定的酸酐。
(三) 烯烃KMnO4氧化可能机理
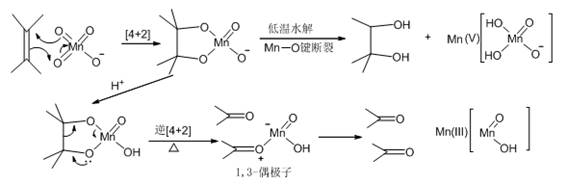
无论什么条件,氧化第一步都是一个类Diels-Alder反应生成一个氧锰氧杂五元环中间体。该中间体在冷稀碱性条件下,主要发生MnO键断裂,生成邻二醇和5价锰;而在加热条件下则发生类Diels-Alder反应的逆反应,协同开环生成一分子羰基化合物以及羰基化合物与3价锰的配合物,后者不稳定立即分解为羰基化合物和3价锰。
(四) 乙烯基乙炔合成2-氯-1,3-丁二烯的可能机理
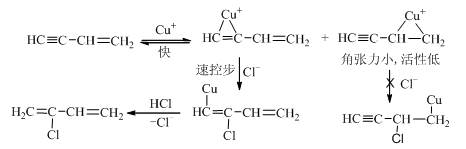
生成钅翁离子一步是软酸亲软碱,很快;亲核试剂Cl-进攻角张力大的由三键形成的铜钅翁离子容易,所以三键更容易发生亲核加成。
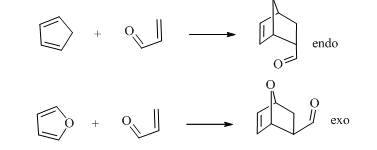
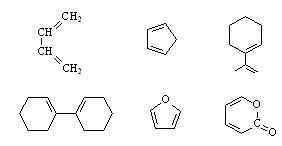
(五) 环戊二烯作为双烯体的活泼性和立体导向作用:
环戊二烯是活泼的双烯体,主要原因是亚甲基把两个双键锁定为s-顺式构象。环戊二烯与顺酐、丙烯醛、丙烯酸以及衍生物反应主要得到内型(endo型)产物,主要是在过渡态中,即将生成的富电子的π轨道与羰基缺电子的π*反键轨道之间存在次级轨道相互作用,降低了反应的活化能。呋喃与上述亲双烯体通常得到外型(exo型)产物,此时主要是富电子的氧原子的sp3杂化轨道与羰基缺电子的π*反键轨道之间存在次级轨道相互作用更有效。
(六) 诺贝尔奖获奖者工作介绍
1950年诺贝尔化学奖得主是德国化学家第尔斯及其学生阿尔德。
第尔斯(Otto Diels,1876-1953)1895年在德国柏林大学获得博士学位,他是著名有机化学家E. Fischer(1902年诺贝尔化学奖得主)的学生。毕业后在柏林大学任Fischer的助手,1916年被聘为德国基尔大学教授。
阿尔德(Kurt Alder,1902-1958)先后在柏林大学、基尔大学学习,1926年获得博士学位,他是第尔斯的学生。阿尔德先后在基尔大学、法本化学工业公司研究所、科隆大学工作。
1925年第尔斯发现偶氮二甲酸与环戊二烯反应,形成了新的C-N键:
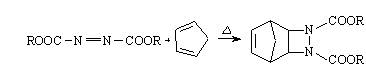
1927年第尔斯和阿尔德又发现丁二烯类化合物和烯烃的衍生物可以发生类似的加成反应形成新的C-C键,例如:
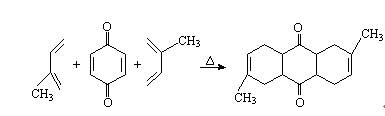
在反应物中生成了新的六元环。这个反应具有普遍性,它适用于一系列二烯类化合物和一系列烯烃类化合物,可以用通式表示如下:
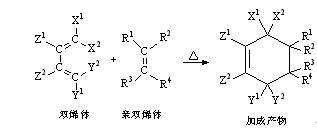
这个反应后来被称为Diels-Alder反应(简称为D-A反应),它是双烯体和亲双烯体进行环加成,生成六元环状化合物的反应,又叫双烯合成反应。其中的双烯体可以是下列化合物:
而其中的亲双烯体可以是:
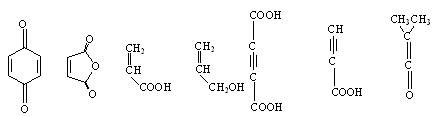
当双烯体分子中具有给电子基团和亲双烯体分子具有吸电子基团时,有利于反应的进行。Diels-Alder反应是一个协同反应(周环反应),在反应过程中旧的化学键断裂和新化学键的形成是通过环状过渡态同时发生的。
从发现Diels-Alder反应到1950年的20多年时间,这一反应引起了广泛重视,并被极大地扩展为含有杂原子的体系。例如:C=C-C=O、N=C-C=N也可作为双烯体系参与反应,而=C=O、-N=N-、-C=N和-N=O同样可以做为亲双烯体参与反应。Diels-Alder反应为人们提供了一种新的合成方法,它已被广泛应用于医药、农药、染料等工业生产。第尔斯和阿尔德因发现Diels-Alder反应而共同获得1950年诺贝尔化学奖。
1973年诺贝尔化学奖得主威尔金森(Geoffrey Wilkinson,1921-1996)1946年获伦敦帝国学院博士学位,从1946年起先后在美国的加利福尼亚大学伯克利分校、哈佛大学以及英国伦敦大学帝国学院任教授。
格氏试剂与过渡金属卤化物反应,常用于制备偶联产物,例如:
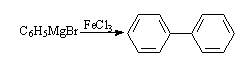
1951年Kealy和Pauson在利用环戊二烯基格氏试剂进行类似的偶联反应时,意外地得到了二环戊二烯基铁,而不是C5H5-C5H5:
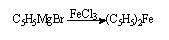
(C5H5)2Fe后来被称为二茂铁。Pauson在《自然》杂志上发表的论文提出了下列结构:
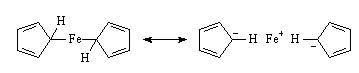
当时在哈佛大学工作的威尔金森看了Pauson的论文后,惊呼道:“上帝啊,不应该是那样的!” 威尔金森认为环戊二烯环与Fe以s键直接相连的结构,不可能有那样高的稳定性,以致在空气中能够加热升华。正当威尔金森在苦苦思考的时候,伍德沃德(R. B. Woodward,因研究天然产物的全合成而获得1965年诺贝尔化学奖)课题组的学生走来问他的实验室是否有氯化钌。威尔金森马上意识到伍德沃德可能也在考虑这个问题,因为元素周期表中Fe下面是Ru,如果Fe能够与环戊二烯反应,那就可是尝试一下Ru,这时化学家们的逻辑。于是威尔金森邀请伍德沃德一起在学校的教工餐厅讨论,决定进行合作研究。他们制备了钌、钴、镍等金属的环戊二烯基络合物,并应用当时最新的研究手段如红外光谱、核磁共振等,确定了环戊二烯基的质子是全部等价的。二人一起发表了论文,他们认为二茂铁具有三明治结构,二茂铁的两个五元环都带六个π电子,它们作为一个整体同铁形成稳定的络合物。这种结构后来被X-射线晶体结构分析验证。因为这个化合物具有与苯(benzene)类似的芳香性,伍德沃德建议将这个化合物命名为ferrocene,它作为二茂铁的英文名称一直沿用至今。
当时,任哈佛大学副教授的威尔金森每日忙于教学和科学研究,甚至从来没有在午夜两点之前回家过。事实上那时对二茂铁的研究具有很高的竞争性。在大洋彼岸,德国的费歇尔(E. O. Fischer,与威尔金森共同获得1973年诺贝尔化学奖)也在竭力研究二茂铁,几乎与威尔金森、伍德沃德同时,他也发表了文章,阐述了类似的结构。不过费歇尔将二茂铁的结构称为双圆锥形化合物,这不如三明治的称呼会引人产生兴趣甚至食欲。
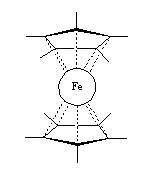
威尔金森从美国哈佛大学回到英国伦敦大学后继续进行金属有机化合物的合成与结构研究,并合成了一系列过渡金属的环戊二烯化合物,同时他还对过渡金属的羰基化合物、芳基或烷基化合物、过渡金属氢化物等进行了系统的研究。例如下列化合物:
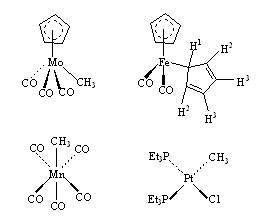
特别是他还发现了过渡金属均相催化加氢催化剂RhCl(PPh3)3,后来被称为威尔金森催化剂,已被广泛应用于有机化合物中不饱和键的还原反应中。威尔金森催化剂在溶液中能和H2反应,并能和烯烃形成络合物,它对烯烃的氢化反应是在均相中进行的。